離子鍵
離子鍵,又曰鹽鍵,化學鍵也,存於正負離子之間。有原子、原子團者,得失電子而生荷,乃為離子也。正負電荷者相吸,遂生力矣。
夫離子鍵者,並金屬、非金屬多有之。金屬去以電子,為正離子;非金屬得之,為負離子。因電磁力所牽,生化學鍵矣。離子鍵者,強於氫鍵而近共價鍵矣。
僅以系統減能之時,方能生效矣。所去多者,生鍵為強矣。
觀其實者,無有「純」離子鍵也。夫鍵者,常有共價之性。成鍵之原子者,電負相衡者,離子鍵性為低矣。

|
|
|
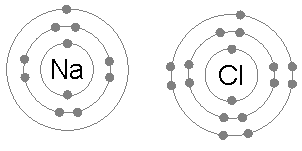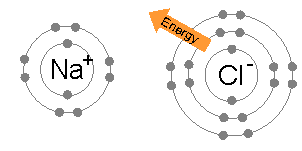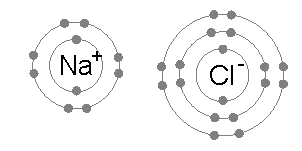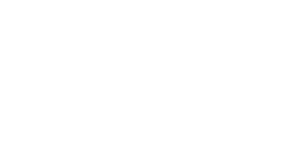
上示鋰、氟之電子分佈。鋰者,至外電子有一,原子核之所牽力弱(第一電離能少矣)。氟者,至外電子達七。若置鋰者電子乎氟者之外層軌道,則兩原子之分佈俱成惰氣之類矣。負鍵能者,可使成鍵之能低乎未成鍵者也。 |
兩離子之所牽者(宛如Na+並Cl−者)生離子鍵矣。電子軌道素不重疊(因而未生分子軌道)。兩離子者,俱為最低能級,而鍵者,正負離子之電磁力所生也。 |
| 聲音動静,具錄於維基共享︰離子鍵 |

