硫酸
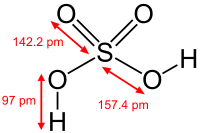
硫酸者(化學式︰H2SO4),又曰漒水、鏹水、綠礬油、磺強、石膽精。偏分子化合物也,屬酸,性烈。三酸兩鹼處一焉。

故謂綠礬油,蓋餾綠礬(硫酸亞鐵,硫酸成鹽之一也。)出油,故名之。
有用實蕃,古人譽曰「化學工業之母」也。
性
纂硫酸者,可溶於水中而釋氫離子,可通電,故為電解質。
製
纂欲製硫酸,現有濕硫酸法、接觸法,古有鉛室法
接觸法
纂- S (s) + O2 (g) → SO2 (g)
用五氧化二釩作催化劑,二氧化硫並氧得三氧化硫
- 2SO2 (g)+ O2 (g) → 2SO3 (g)
三氧化硫並硫酸得發煙硫酸
- H2SO4 (l) + SO3 (g)→ H2S2O7
再加水得硫酸
- H2S2O7 (l) + H2O (l) → 2 H2SO4 (l)
濕硫酸法
纂- S (s) + O2 (g) → SO2 (g)
用五氧化二釩作催化劑,二氧化硫並氧得三氧化硫
- 2SO2 (g)+ O2 (g) → 2SO3 (g)
三氧化硫加水得氣態硫酸
- SO3 + H2O → H2SO4(g)
氣態硫酸凝結為液體硫酸
- H2SO4(g) → H2SO4(l)
實驗室中
纂- S (s) + O2 (g) → SO2 (g)
加雙氧水而生硫酸
- SO2 + H2O2 → H2SO4
意外處理
纂其之濺身,當以乾布拭去,并輔以小蘇打。勿以水,其遇水生熱而將灼傷也。 然,或有言之,曰硫酸濺身,當以水激之,水攜熱而去,不傷身也;若以布拭之,不能拭凈,殘酸腐肌,為之奈何?
用
纂硫酸者,其用多也。可導通水渠,亦可為電池之電解質。於分析化學之中,可用於滴定。
反應
纂複分解反應:如:2NaOH+H2SO4===Na2SO4+2H2O以彰酸之通性
置金屬於硫酸,氫氣頓生,並以鹽。
稀釋
纂取水,徐徐注硫酸者入瓶中,莫疾。水者,性高比熱熱容,故能儲硫酸解解離之熱也。手拌溶液莫停。
若注水入酸中者,巨熱為放,酸水濺,恐傷膚也。